ChIP后DNA建库问题及解决方案
ChIP后富集的DNA总量常常只有ng级。相比组蛋白修饰,转录因子的ChIP后DNA总量往往更低,一般在10ng以下。除了DNA得率外,Input/IP DNA的纯度和片段分布、磁珠纯化、DNA模板/Adapter投入量等都会影响建库的成功率,可能导致文库产出低/无产出、文库存在大量接头二聚体等问题。本期,针对ChIP后DNA建库可能出现的问题,小编分享一下康测科技这方面的成功经验,希望可以对大家的科研带来帮助~
问题:文库产出低或无产出
可能原因:
DNA纯度差:Input/IP DNA制备过程中带入高浓度金属离子螯合剂或其他盐,可能会影响End repair步骤的效率;
解决办法:Input/IP-DNA提取方式采用柱式法进行回收或者建库前将模版DNA使用2XNGS磁珠进行纯化去除杂质干扰;
文库纯化环节中磁珠干燥过度或者干燥不充分:产物洗脱前应将磁珠置于室温干燥。干燥不充分容易造成无水乙醇残留影响后续反应;过分干燥又会导致磁珠表面可能会出现龟裂,导致DNA难以洗脱,得率降低;
解决办法:磁珠洗涤后弃掉上清后进行闪甩,在磁力架上用10 μL枪头吸尽管底残余乙醇,同时室温干燥5-10min,肉眼及时观察磁珠状态;
Input/IP-DNA片段分布不合格:正常DNA片段化分布要求主峰在200-500bp之间,因为二代测序的文库分布标准为300-500bp,可以理解为我们的文库插入片段长度在200-400bp之间,若Input/IP-DNA分布存在异常,则我们投入相同量的模版,实际用于文库构建的DNA量其实低于正常量,因此,导致文库产出低,文库中不同片段的扩增效率也会不一致;
解决办法:调整Input/IP-DNA片段化条件,使其主要分布在200-500bp;建库前对模版DNA进行纯化或者分选去除大片段或者小片段。
问题:文库存在接头二聚体(Adapter Dimer)
可能原因:
DNA模板投入量与接头的使用量不匹配:过量的Adapter会产生Adapter Dimer;Adapter投入量不足又会影响连接效率进而导致文库产出降低;
解决办法:因此需要根据模版量确认接头使用浓度
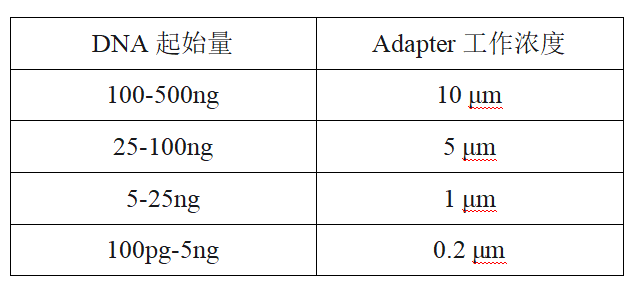
样本特性:损伤较为严重的DNA存在接头连接效率低;
解决办法:可对接头连接后的产物进行2次磁珠纯化。这样可以显著降低Adapter或Adapter Dimer的残留水平;或者增加DNA模版的投入量;
磁珠分选比例不恰当:若PCR产物Adapter Dimer条带比较亮,按常规0.6X+0.2X进行分选可能就无法完全去除;
解决办法:文库PCR产物分选环节二轮分选中应该适当减少磁珠使用量,使用0.6X+0.1X进行分选;或文库进行0.6X+0.2X二轮分选完后采用0.7X将文库进行纯化。
总之,ChIP后DNA建库过程中的每一个环节都至关重要,任何一个小问题都可能影响最终的实验结果。希望大家在注意以上细节后,都能获得高质量的DNA文库!
ChIP为什么选康测?
康测目前已完成数千个IP(ChIP、RIP、CLIP、MeRIP)项目,包括50多个物种的各类蛋白,如组蛋白(H3K4me3、H3K9me3、H3K27me3、H3K36me3、H3K14ac等)、转录因子、解旋酶、剪接因子,不惧复杂组织挑战,成功率近100%。并提供实验原始图片,审核无忧!若想了解更多关于ChIP-seq的内容,欢迎留言/私信小编哦,更多ChIP-seq高分文献解读、示例报告等着大家~

点一下“在看” 再走吧~(右下角)


热点推荐
更多平台
bilibili
(长干货科普)
视频号
(产品知识分享)
小红书
(短干货科普)



关于康测
康测致力于先进组学技术的开发和在生物医学研究领域的应用,建立了涵盖基因组学、表观基因组学、转录组学、表观转录组学、免疫组学和互作组学的全面组学服务体系。而在医学检测方面,康测基于自主研发的SMP(Stranded Multiplex PCR)靶向测序技术,可提供检测灵敏度和特异性均为100%的MRD一站式自动化解决方案。

康测提供全面的基因表达调控研究工具

康测提供高度自动化MRD一站式解决方案

















