-
-
-
核心技术 >
检测服务 >
产品/解决方案>
-
转录因子(transcription factor, TF)是序列特异性DNA结合蛋白,可调节所有生物体中的基因表达,它们占全部物种所有蛋白编码基因的4~10%。例如,模式植物拟南芥中有2492个基因编码TF,占其总蛋白质编码基因的9%以上。
DAP-seq(DNA affinity purification sequencing,DNA亲和纯化测序)属于类ChIP-seq(染色质免疫沉淀测序,Chromatin immunoprecipitation sequencing)的体外实验。它通过体外蛋白表达技术,表达出带有标签的TF,和基因组DNA文库在体外进行结合,然后分离出与TF结合的DNA,再使用高通量测序,找到TF的结合位点。 DAP-seq的基本步骤包括:a)获得基因组
DNA,打断后连接测序接头;b)表达连接标签的融合蛋白(目标TF);c)融合蛋白连接抗体直标磁珠;d)基因组DNA与目标TF融合蛋白一起孵育,利用磁铁富集与目标TF结合的DNA片段,并进行测序。如下图所示:

服务流程
您只需要提供目标TF的cDNA、TF-标签融合基因的质粒或者表达好的目标TF及其抗体(三选一),和用于基因组DNA提取的样品,剩下的工作我们来完成!

技术优势
全面鉴定基因组上转录因子结合位点(transcription factor binding sites, TFBS)对于表征调控元件和TF功能至关重要。ChIP-seq一直是检测体内TFBS的金标准。然而,ChIP-seq并非所有情况都适用,因为:
- ChIP-seq依赖于抗体质量,人、小鼠等这些常见模式物种的热门TF,通常有商业化的ChIP级抗体可用,但对于非热门TF或非模式物种,往往没有可用的商业化抗体;而制备ChIP级抗体难度大,周期长,很不可控。
- 对于没有抗体的TF,替代方案之一是通过转基因的手段,将重组TF序列导入到细胞或实验动/植物体内,表达TF-标签(如FLAG肽段或绿色荧光蛋白GFP)融合蛋白,再利用标签抗体,实现目标TF的ChIP-seq;然而,对于某些物种,转基因实验难度很大或周期很长,实验门槛极高。
- TF在植物的体内表达量低,还存在时空特异性,取得足量特定生长时期的特定部位组织,往往并不容易。
DAP-seq成功将体内结合实验转移到体外,解决了ChIP抗体制备的困扰,极大的提高发现TFBS的效率;不仅能够超高通量查找TFBS,还能深入了解众多TF的生物学特性和TFBS结构,在有机体的表观研究中表现出巨大的价值。

但是,DAP-seq作为一种体外实验,某些缺点是不可避免的:
- 很多TF在体内起作用必须要有其他配体蛋白的协助,但在体外环境下,缺乏这些条件;体外环境下,蛋白翻译后无法正常折叠或形成多聚物,从而无法行使在体内环境类似的功能。这与TF的类型(即TF家族)高度相关,因此,如果想用DAP-seq研究某个目标TF,则可以先查询在之前的研究中,该TF隶属家族的成功率如何,从而预估目标TF的实验成功率。
- DAP-seq无法检测组蛋白修饰、染色体开放程度等因素对TF作用的影响,因此,DAP-seq不适用于研究TF与DNA作用的动态变化,研究静态TFBS时,一个物种只需做一次。
示例结果
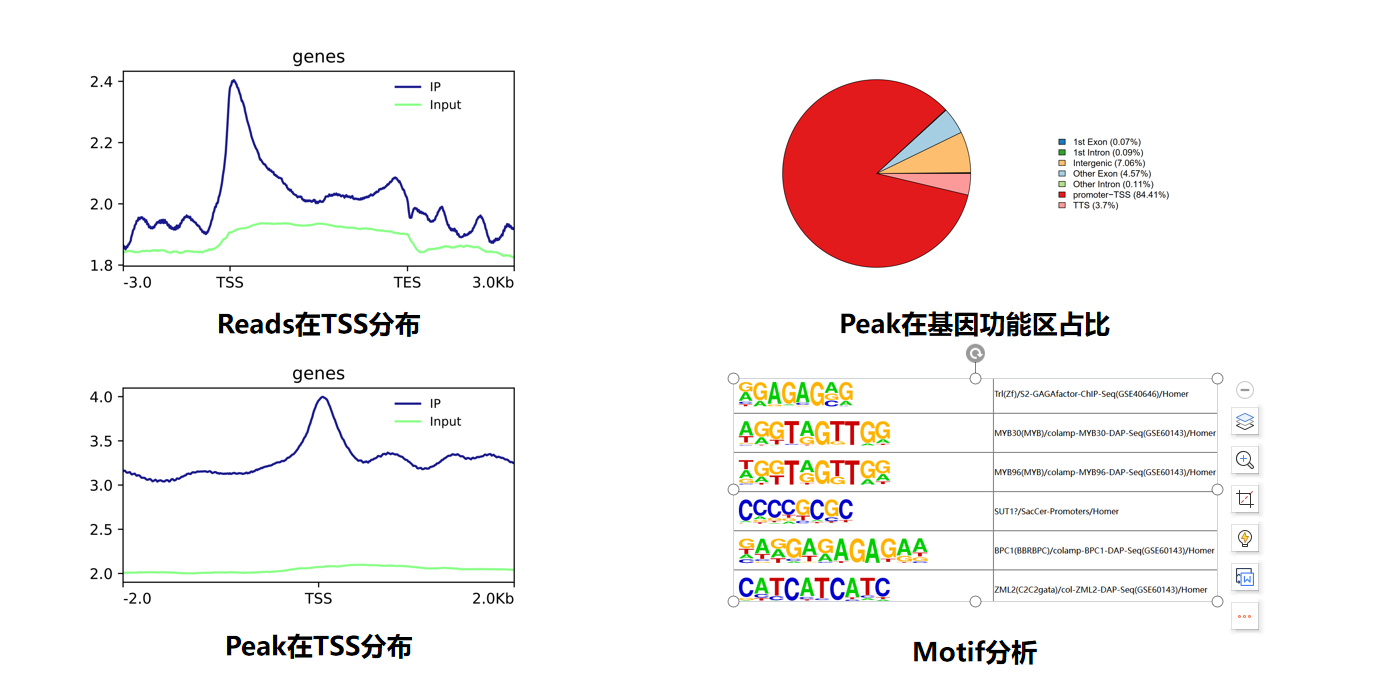
案例分析
Cell: Cistrome and Epicistrome Features Shape the Regulatory DNA Landscape1
本研究对比了ChIP-seq和DAP-seq两种方法检测给定TF结合位点的效果,通过DAP-seq,解析了拟南芥中529个TFs的peaks和motifs。
1)TF ABI5的ChIP-seq和DAP-seq peak区域高度一致,解析到的motif序列也高度一致。

2) DAP-seq能够大规模、高通量的转录因子的TFBS和motifs,在鉴定的529个TFs中,有57个代表性的motifs。

DAP-seq(DNA亲和纯化测序)
联系我们
地址:武汉市江夏区东湖新技术开发区高新六路99号南山·光谷自贸港A栋6楼
邮箱:seqhealth@seqhealth.cn
电话:027-65527552
热门服务
关注康测公众号











